上海万生昊天生物技术有限公司
11 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 2.7
- 2.7
技术资料/正文
实验指南 | 蛋白样品制备1——细胞裂解完全指南
43 人阅读发布时间:2025-12-09 10:50
Western Blot(WB)实验中,细胞裂解是蛋白样品制备的第一步,也是影响实验成败的关键。有效的裂解能完整释放目标蛋白,并保持其活性与结构,为后续步骤奠定基础。
蛋白质提取的目的是破坏细胞膜与细胞器膜,将蛋白释放到溶液中,同时保持其完整性。基本原理是利用化学、物理或机械方法破碎细胞结构。
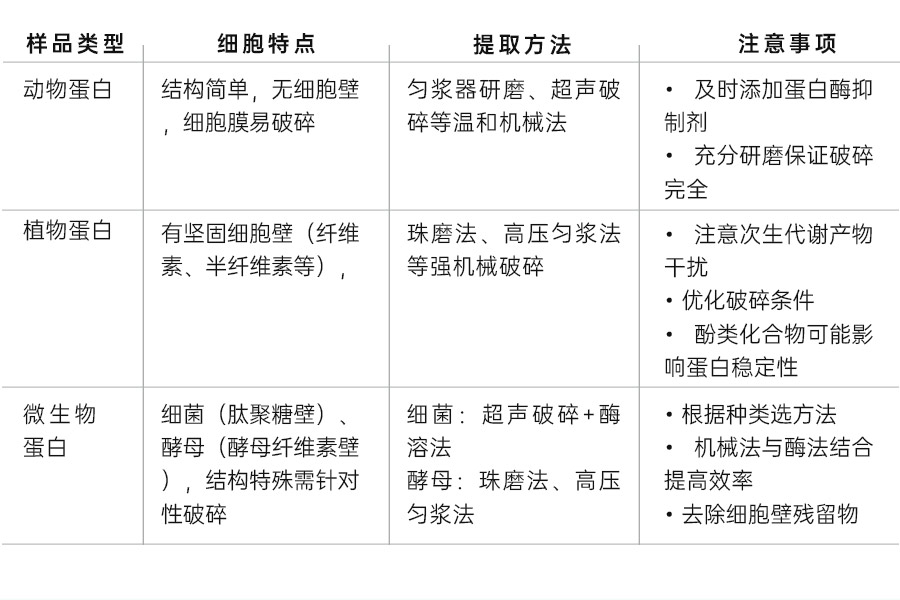
一、不同来源的蛋白质样品提取方法
二、细胞裂解五大常见误区
误区一:采用“一刀切”的裂解方案
错误做法:许多研究者习惯用同一套裂解流程处理所有样品(如组织、贴壁细胞、悬浮细胞),忽略其结构差异。
原因分析:动物组织柔软但需研磨;植物细胞有细胞壁需机械破碎;微生物(如细菌)细胞壁成分特殊。若方法不当,会导致裂解不完全或蛋白降解。
正确做法:根据样品特性选择破碎方法。例如,动物组织优先用匀浆器研磨,贴壁细胞可直接加裂解液吹打;植物组织则采用珠磨法或高压匀浆法等机械破碎方法。
![]()
![]()
误区二:选错裂解液
错误做法:随意选用高强度裂解液(如强RIPA),认为“越强越好”,或忽略下游实验(如Co-IP需避免SDS)。
原因分析:高强度裂解液可能破坏蛋白互作或导致过度变性;而弱裂解液对膜蛋白提取不足。
正确做法:根据目标蛋白的溶解性和实验目的选择裂解液。例如:
可溶性蛋白:用中/弱强度RIPA或NP-40裂解液。
膜蛋白或核蛋白:优选强RIPA裂解液。
Co-IP实验:避免离子型去垢剂,选择温和裂解液。
![]()
![]()
误区三:蛋白酶抑制剂使用不当
错误做法:抑制剂添加不及时(如裂解液配制后久置)、浓度不准确,或忽略磷酸酶抑制剂(用于磷酸化蛋白研究)。
原因分析:细胞裂解释放的内源性蛋白酶会快速降解目标蛋白;PMSF等抑制剂在水中半衰期短,需现用现加。
正确做法:
现用现配:抑制剂在裂解前1-2分钟加入,确保活性。建议直接使用商品化蛋白酶抑制剂Cocktail,覆盖谱广且稳定。
浓度精准:参考蛋白酶抑制剂的工作浓度表,例如PMSF常用0.1-1.0 mmol/L。
![]()
![]()
误区四:忽略操作温度与时间控制
错误做法:裂解过程在室温下进行,或裂解时间过长(如超过30分钟),认为“时间越久越彻底”。
原因分析:高温会加速蛋白酶活性和蛋白变性;过度裂解可能释放基因组DNA,导致样品粘稠。
正确做法:
全程低温:操作在冰上进行,裂解液预冷。
时间优化:多数细胞裂解仅需1-2秒,组织需研磨至匀浆;离心步骤在4℃下进行。
注意事项:若裂解产物出现透明胶状物(基因组DNA),可短暂超声处理或离心取上清。
![]()
![]()
误区五:样品储存与处理不规范
错误做法:裂解后样品反复冻融,或未分装储存,直接用于长期实验。
原因分析:冻融循环会破坏蛋白结构,引起聚集或降解。
正确做法:
分装保存:裂解产物分装后于-80℃储存,避免多次冻融。
现用现制备:组织取材后分装,裂解后尽快用于下游实验。
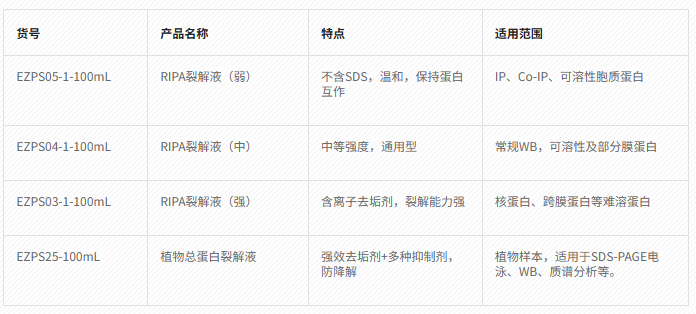
三、万生昊天RIPA裂解液选择指南